一、申报条件:
(1)申办、变更许可证需按照《实施细则》或GMP检查验收的,暂由省局负责受理。
(2)企业申报生产品种在现行《医疗器械分类目录》及国家局有关分类界定的有效文件明确的,由企业自行归类并对判定结果负责。对于企业无法自行判定,经与省以下监管部门沟通仍不能判定的,企业可提出书面申请并提供证明材料,由市局负责上报省局,再由省局转报国家局核定。
二、变更所需资料
①变更事项:
Ⅰ《医疗器械生产企业许可证》企业名称变更(登记事项变更);
Ⅱ《医疗器械生产企业许可证》法定代表人、企业负责人变更(许可事项变更);
Ⅲ《医疗器械生产企业许可证》注册地址变更(许可事项变更);
Ⅳ《医疗器械生产企业许可证》生产地址变更(许可事项变更);
Ⅴ《医疗器械生产企业许可证》生产范围变更(许可事项变更);
②提交材料及要求:
Ⅰ相关变更事项统一提交材料及要求:
《医疗器械生产企业许可证》(变更)申请表;
《医疗器械生产企业许可证》副本复印件;
企业变更的情况说明
Ⅱ相关变更事项另需提交材料及要求:
◆《医疗器械生产企业许可证》企业名称变更(登记事项变更):
工商行政管理部门出具的企业名称核准通知书或营业执照原件和复印件(加盖企业公章);
企业变更的情况说明
◆《医疗器械生产企业许可证》法定代表人、企业负责人变更(许可事项变更):
法定表人、企业负责人的基本情况及资质证明,包括身份证明,学历证明,职称证明,任命文件的复印件,工作简历;
申请材料真实性的自我保证说明。
◆《医疗器械生产企业许可证》注册地址变更(许可事项变更);
工商行政管理部门出具的企业名称核准通知书或营业执照原件和复印件;
申请材料真实性的自我保证声明。
◆《医疗器械生产企业许可证》生产地址变更(许可事项变更):
生产产场地证明文件,包括房产证明或租赁协议和被租赁方的房产证明的复印件,厂区总平面图,主要生产车间布置图。有洁净要求的车间,须标明功能间及人物流走向;
拟生产无菌医疗器械的,需提供洁净室的合格检测报告。由省级食品药品监督管理部门认可的检测机构出具的一年内的符合《无菌医疗器具生产管理规范》(YY0033)的合格检验报告;
申请材料真实性的自我保证声明。
◆《医疗器械生产企业许可证》生产范围变更(许可事项变更):
申请材料真实性的自我保证声明。
产品标准应按照申请表所填写的产品品种提供。
主要生产设备及检验仪器清单;
拟生产产品的工艺流程图,并注明主要控制项目和控制点。包括关键和特殊工序的设备、人员及工艺参数控制的说明;
拟生产无菌医疗器械的,需提供洁净室的合格检测报告。由省级食品药品监督管理部门认可的检测机构出具的一年内的符合《无菌医疗器具生产管理规范》(YY0033)的合格检验报告;
申请材料真实性的自我保证声明。
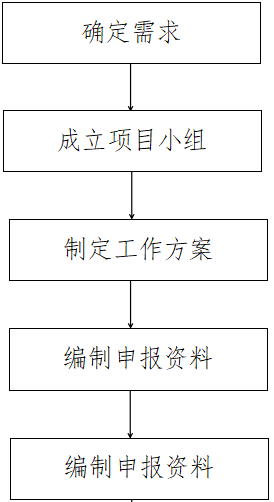
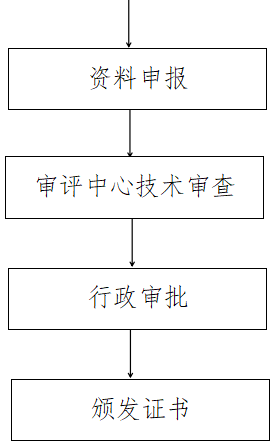
三、服务流程
四、服务内容
1. 提供确认生产场地符合要求的相关咨询服务
2. 提供确认生产、检验设备符合要求的相关咨询服务
3. 提供人员团队建立的咨询服务
4. 提供产品试生产相关技术咨询服务
5. 提供试生产过程风险评估及管理的服务
6. 提供批生产记录制作的咨询服务
7. 提供产品相关工艺验证的咨询服务
8. 提供质量管理体系文件咨询服务
五、常见问题